O que é atrofia
geográfica?

A carga crescente da degeneração macular relacionada à idade (DMRI)
A atrofia geográfica é uma forma avançada de DMRI1–3 que causa degeneração progressiva e irreversível da mácula.3–6
A prevalência global da DMRI está crescendo a uma taxa exponencial.2

A DMRI é uma das principais causas de perda permanente da visão8
Em 2020, as principais causas foram catarata, seguida de glaucoma, erro refrativo subcorrigido, DMRI e retinopatia diabética.8
Causas de perda permanente da visão em pessoas com mais de 50 anos de idade
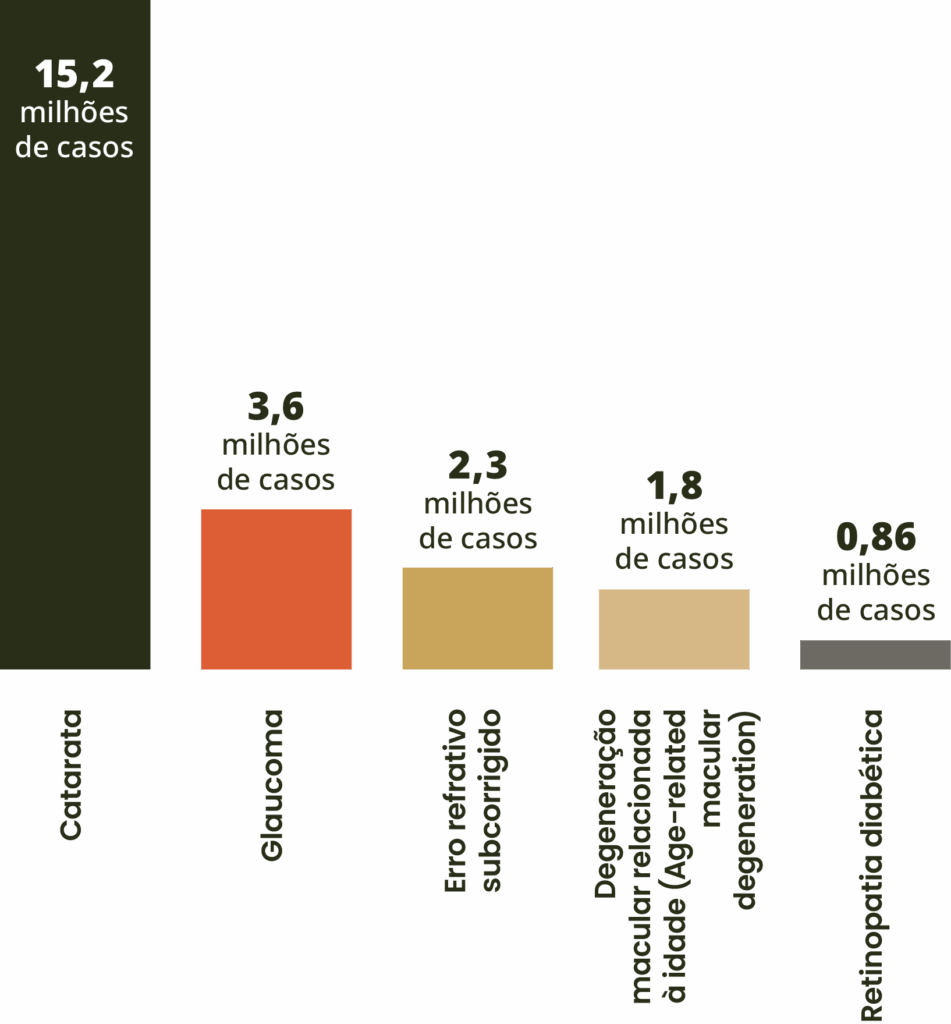
Adaptado de GBD 2019.8
Entre esses casos globais de DMRI, espera-se que o número de pacientes diagnosticados com casos de atrofia geográfica quase quadruplique – aumentando de 5 milhões para mais de 18 milhões até 2040.2,3
Causas de perda permanente da visão em pessoas com mais de 50 anos de idade
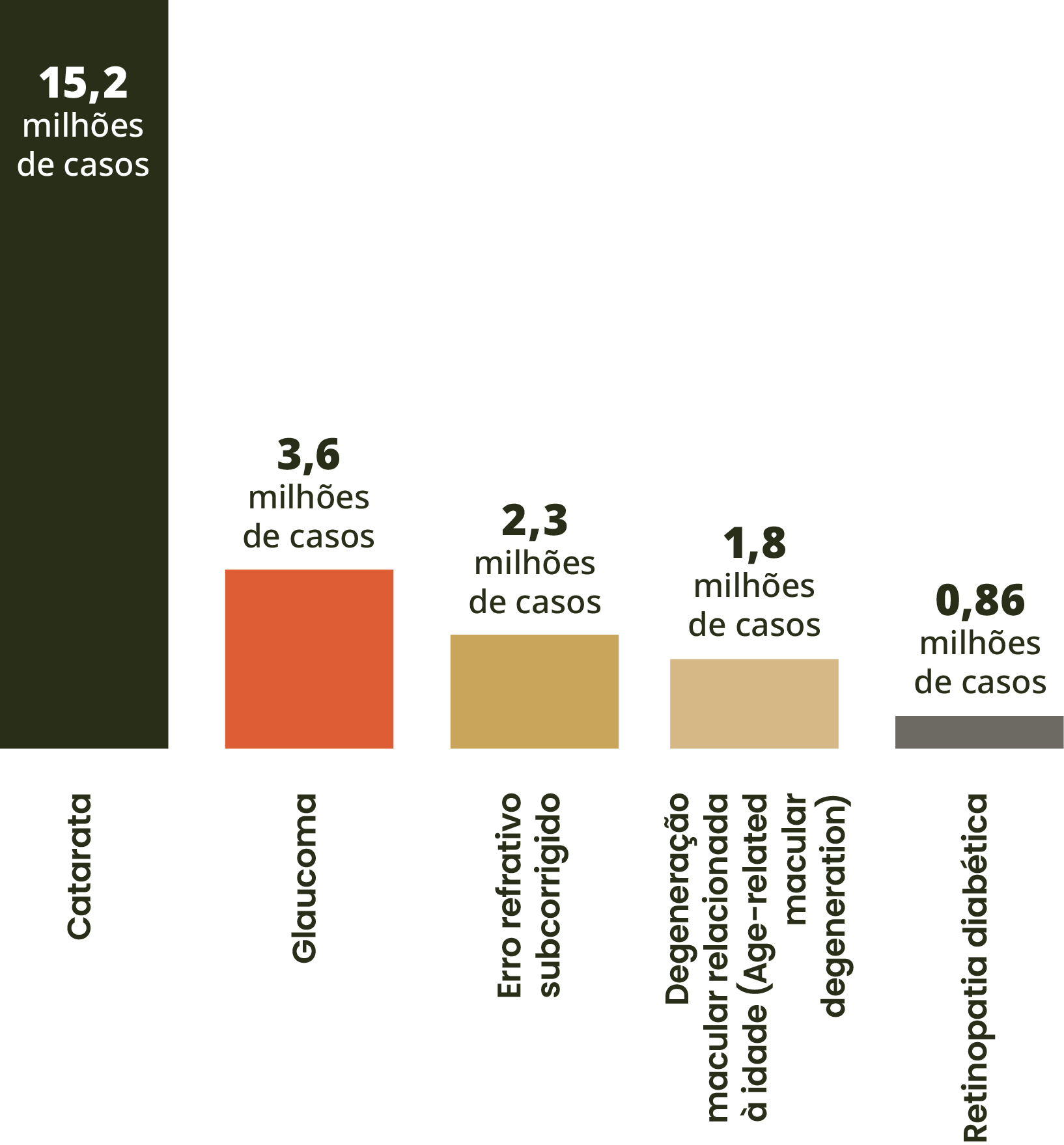
Adaptado de GBD 2019.8
Em 2020, as principais causas foram catarata, seguida de glaucoma, erro refrativo subcorrigido, DMRI e retinopatia diabética.8
Entre esses casos globais de DMRI, espera-se que o número de pacientes diagnosticados com casos de atrofia geográfica quase quadruplique – aumentando de 5 milhões para mais de 18 milhões até 2040.2,3
Formas de DMRI avançada
A DMRI avançada tem duas formas: atrofia geográfica e neovascularização coroidal (DMRI úmida).9

A DMRI avançada é menos prevalente do que os estágios inicial e intermediário,10 no entanto, geralmente é altamente sintomática e pode levar à perda permanente da visão.7

Atrofia geográfica (AG) e DMRI úmida são consideradas manifestações diferentes da DMRI avançada, mas podem ocorrer simultaneamente no mesmo olho. Pacientes com AG podem desenvolver naturalmente DMRI úmida.9
Causas da atrofia geográfica
A DMRI é uma doença complexa e multifatorial e a patogênese da GA envolve uma interação complexa de fatores genéticos, fisiológicos e ambientais.11–14

Genética
- Formação de drusas
- Formação de espécies reativas de oxigênio
- Inflamação
- Resposta imune, incluindo complemento

Fisiologia
- A idade é o maior fator de risco para AG

Ambiente
- Luz solar, tabagismo e dieta
- Alto consumo de álcool
Avaliação da gravidade da DMRI e do risco de progressão
O sistema de classificação de Beckman reconhece um risco crescente de desenvolvimento de DMRI avançada.15 Esse sistema requer apenas um exame clínico ou imagem colorida do fundo de olho para observar e analisar anormalidades da retina.16
Classificação clínica da DMRI de Beckman
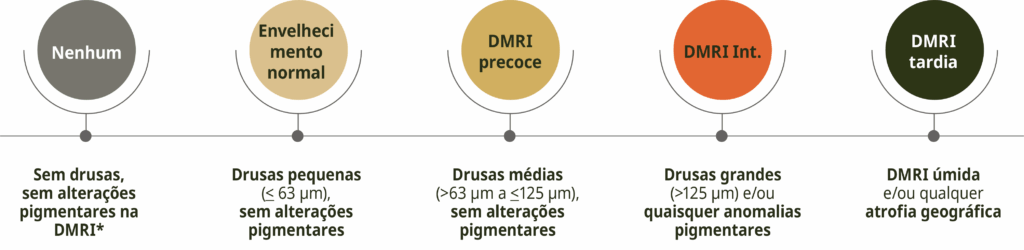
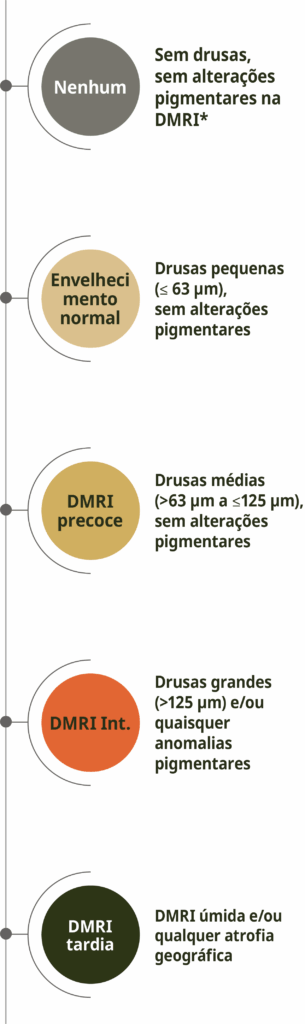
Adaptado de Ferris III et al. 2013.15
A classificação é baseada na avaliação de lesões do fundo ocular dentro de dois diâmetros de disco da fóvea em pessoas com mais de 55 anos de idade. A presença de drusas grandes (> 125 μm) e/ou anormalidades pigmentares indica DMRI intermediária com alto risco de progressão para DMRI avançada.15
A avaliação de seus pacientes com a escala de Beckman evita ambiguidade quanto ao estadiamento da DMRI e oferece suporte a uma classificação consistente.16
*Anormalidades pigmentares da DMRI são definidas como quaisquer anormalidades hiper ou hipopigmentares definidas associadas a drusas médias ou grandes, mas não associadas a entidades de doenças conhecidas.15
Diagnóstico da atrofia geográfica
Técnicas de imagem da retina são usadas para identificar, diagnosticar e monitorar todos os estágios da DMRI, incluindo a AG.17
Ao diagnosticar e monitorar a DMRI, as seguintes características podem ser detectadas na retina:17
- Presença de drusas
- Uma área nitidamente demarcada na região macular com uma retina atrófica, sem pigmentação
- Vasos sanguíneos coroidais subjacentes visíveis
Uso de imagens multimodais para avaliar a gravidade da AG e o risco de progressão16,18
Devido à baixa correlação entre a melhor acuidade visual corrigida e as lesões ou progressão da atrofia geográfica, uma abordagem de imagem multimodal é recomendada para melhor acompanhamento dos pacientes com AG:18
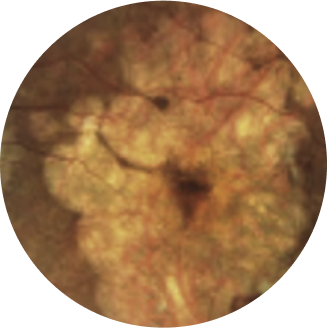
A retinografia colorida tradicionalmente documentou lesões de GA como uma transição abrupta da pigmentação do fundo de olho resultante da atrofia de células do epitélio pigmentar da retina (retinal pigment epithelium, RPE)18
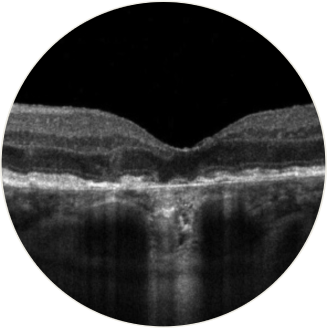
A tomografia de coerência óptica de domínio espectral fornece imagens detalhadas e in vivo da mácula. Exames de GA revelam afinamento do RPE, depressão das camadas internas da retina à medida que as camadas externas são perdidas e aumento da visibilidade dos complexos de Bruch. Áreas atróficas mostram aglomerados de material hiperreflexivo, placas segmentadas da faixa externa com refletividade variável e faixas hiperreflexivas externas espessadas. Desidratação e calcificação de drusas também são observadas na tomografia de coerência óptica (TCO19
- A TCO revelou detalhes quase histológicos do que parecem ser os primeiros sinais de perda celular e o início da atrofia em olhos com DMRI que apresentam apenas drusas e anormalidades pigmentares, antes dos sinais clinicamente aparentes da AG16
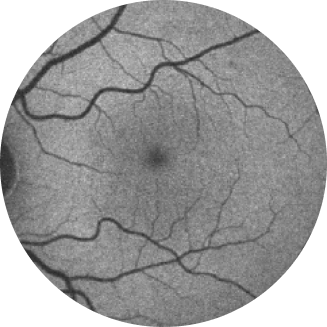
A autofluorescência do fundo de olho é útil para monitorar o aumento progressivo da AG, permitindo uma medida mais reprodutível de áreas atróficas e uma melhor discriminação do limite da lesão. A perda de autofluorescência do EPR indica dano ou morte de células fotorreceptoras e/ou do EPR18
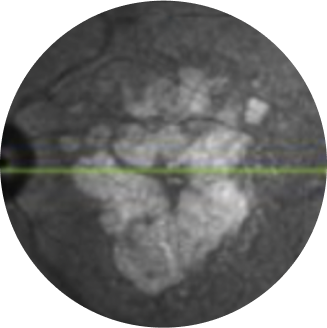
A refletância no infravermelho próximo combinada com autofluorescência do fundo ocular pode indicar preservação da fóvea, o que é importante para a acuidade visual dos pacientes20
O grupo CAM (Classification of Atrophy Meetings, [Encontros de Classificação da Atrofia]) recomenda a TCO como o padrão de referência para diagnóstico e estadiamento da atrofia geográfica.21
A autofluorescência do fundo ocular, a reflectância do infravermelho próximo e a imagem colorida podem ser usadas para ajudar a confirmar um diagnóstico de AG.21
Saiba mais sobre a atrofia geográfica (AG)


Progressão na atrofia geográfica
A atrofia geográfica é progressiva e irreversível, finalmente levando à perda permanente da visão.3–6

Os pacientes podem perder mais do que a visão devido à atrofia geográfica
Eles podem ter dificuldades com independência, relacionamentos e atividades cotidianas.22–24
Junte-se a nós em nossa jornada na atrofia geográfica
Seja o primeiro a receber as últimas notícias sobre atrofia geográfica
Obrigado por enviar seus dados.
Verifique sua caixa de entrada para confirmação
Referências
- Biarnés M, et al. Optom Vis Sci. 2011;88(7):881–889.
- Wong WL, et al. Lancet Glob Health. 2014;2(2):e106–e116 and supplementary appendix.
- Fleckenstein M, et al. Ophthalmology. 2018;125(3):369–390.
- Boyer DS, et al. Retina. 2017;37(5):819–835.
- Lindblad AS, et al. Arch Ophthalmol. 2009;127(9):1168–1174.
- Holz FG, et al. Ophthalmology. 2014;121(5):1079–1091.
- Stahl A. Dtsch Arztebl Int. 2020;117(29-30):513–520.
- GBD 2019 Blindness and Vision Impairment Collaborators. Lancet Glob Health. 2021;9(2):e144–e160.
- Kaszubski P, et al. Ophthalmic Res. 2016;55(4):185–193.
- Li JQ, et al. Br J Ophthalmol. 2020;104(8):1077–1084.
- Buschini E, et al. Clin Ophthalmol. 2015;9:563–574.
- AREDS Research Group. Ophthalmology. 2000;107(12):2224–2232.
- Fritsche LG, et al. Nat Genet. 2016;48(2):134–143.
- Chong EWT, et al. Am J Ophthalmol. 2008;145(4):707–715.
- Ferris FL III, et al. Ophthalmology. 2013;120(4):844–851.
- Guymer R. Rethinking our AMD nomenclature. Retina Today, 2022;32–34.
- EyeWiki. Geographic atrophy. 2021. Disponível em: https://eyewiki.aao.org/Geographic_Atrophy (acessado em fevereiro de 2024).
- Sacconi R, et al. Ophthalmol Ther. 2017;6(1):69–77.
- Elsharkawy M, et al. Diagnostics (Basel). 2021;11(12):2313.
- Lindner M, et al. Invest Ophthalmol Vis Sci. 2017;58(6):BIO61–BIO67.
- Sadda SR, et al. Ophthalmology. 2018;125(4):537–548.
- Sivaprasad S, et al. Ophthalmol Ther. 2019;8(1):115–124.
- Jones D, et al. Invest Ophthalmol Vis Sci. 2022;63(7):A0145.
- Apellis & The Harris Poll. 2022. Geographic Atrophy Insights Survey (GAINS).
BR-PEGGA-2500003 I Setembro 2025